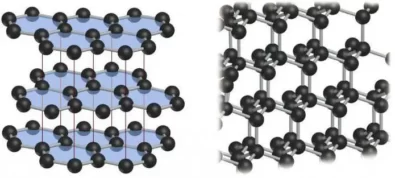
Почему мы говорим «соединения графита» а не «соединения углерода»? Потому что при реакциях графитовые слои не разрушаются и ведут себя как огромные молекулы, сохраняющие свою индивидуальность при разложении соединения. Графитовый слой может выступать как акцептор электронов при взаимодействии с сильными восстановителями или наоборот, как донор электронов при взаимодействии с окислителями.
Наиболее легко образуются соединения с тяжелыми щелочными металлами, начиная с калия. Для такого соединения достаточно контакта графита с избытком парообразного или жидкого металла при температурах от 300°С до 500°С. Соединение графита с калием КС8 имеет вид желтой бронзы и обладает гораздо более высокой электропроводностью, чем сам графит. Реакции внедрения металла в межслоевое пространство графита сопровождаются выделением теплоты, то есть они экзотермичны, и выделение тепла возрастает в ряду К (360) Rb (486) Cs (666 Дж/г графита). При плавном изменении условий синтеза (изменение температуры образца при постоянном давлении паров калия) на кривой состава соединения калия с графитом (аналогично с Rb и Cs) наблюдаются четкие площадки, сообщающие о создании нескольких соединений практически установленного состава, а не о твердых растворах с заметной однородностью за счет постепенного заполнения межслоевого пространства щелочным металлом.